Temas etmek:Erol Çu (Bay.)
Tel: artı 86-551-65523315
Mobil/WhatsApp: artı 86 17705606359
Soru:196299583
Skype:lucytoday@hotmail.com
E-posta:sales@homesunshinepharma.com
Eklemek:1002, Huanmao Bina, No.105, Mengcheng Yol, Hefei Şehir, 230061, Çin
Alnylam Pharmaceuticals, RNAi terapisinin geliştirilmesinde dünya lideridir. İlacı Onpattro (patisiran, intravenöz preparat) Ağustos 2018'de onaylandı ve RNAi fenomeni 20 yıl önce keşfedildiğinden beri pazarlama için onaylanan ilk RNAi ilacı oldu. Kasım 2019'da Givlaari (givosiran, subkutan preparat) onaylandı ve dünya çapında onaylanan ikinci RNAi ilacı oldu. Şu anda,' şirketinin diğer RNAi ilacı lumasiran, ABD FDA tarafından öncelikli incelemeden geçiyor ve Avrupa Birliği EMA tarafından hızlandırılmış onay sürecinden geçiyor. Bu ilaç, birincil hiperoksalüri tip 1'i (PH1) tedavi etmek için kullanılır. FDA, 3 Aralık 2020 olarak bir hedef eylem tarihi belirlemiştir.
Son zamanlarda Alnylam, lumasiran'ı PH1 hastalarının tedavisi için değerlendiren ILLUMINATE-B pediatrik faz 3 çalışmasının olumlu sonuçlarını açıkladı. Bu, klinik çalışmalarda pozitif sonuçlara sahip bir RNAi ilacının yedinci faz 3 çalışması ve 6 yaşın altındaki çocukların (bebekler dahil) tedavisinde RNAi ilaçlarının etkinliğini ve güvenliğini değerlendiren ilk çalışmadır.
ILLUMINATE-B (NCT03905694), dünya çapında 5 ülkedeki 9 araştırma merkezinde 6 yaşın altındaki (aralık: 3-72 ay) 18 PH1 hastasını dahil eden tek kollu, açık etiketli, çok merkezli bir faz 3 çalışmadır. Pediyatrik hastalar. Çalışmada lumasiran, ağırlığa dayalı dozlama programına göre uygulandı.
Sonuçlar, lumasiran tedavisinin 6. ayda idrar oksalat: kreatinin oranında başlangıca kıyasla klinik olarak anlamlı bir düşüşe neden olduğunu gösterdi. İdrar oksalik asitte başlangıca göre azalma, üç ağırlık kategorisinin tamamında tutarlıdır (10 kg'dan az; 10 kg ila 20 kg ve 20 kg veya üstü). Lumasiran ayrıca ek idrar ve plazma oksalat ölçümleri dahil olmak üzere ikincil son noktalarda pozitif sonuçlar göstermiştir. Çalışmada, çalışma ilacıyla ilgili hiçbir ciddi advers olay yoktu ve lumasiranın genel güvenliği ve tolere edilebilirliği, LIMITENT-A çalışmasında gözlemlenenlerle tutarlıydı. ILLUMINATE-B araştırma sonuçlarının tamamı 22 Ekim 2020'de ASN Sanal Konferansı'nda açıklanacak.

PH1 (Resim kaynağı: era-edta.org)
Alnylam' lumasiran projesinin başkan yardımcısı ve genel müdürü Dr. Pritesh J. Gandhi şunları söyledi:" Bu olumlu sonuçları bildirmekten mutluluk duyuyoruz ve bu sonuçların PH1'den etkilenen birçok aileye umut getireceğine inanıyoruz. . Lumasiran'ın güvenliği ve etkinliği 6 yaş ve üzerindeki hastalarda yapılan araştırma raporlarıyla tutarlı olarak, lumasiran'ın her yaştan karaciğerde oksalik asit üretimini önemli ölçüde azaltabileceği kanıtlanmıştır. Bunun PH1'in doğal patofizyolojik problemini çözebileceğine inanıyoruz. Şu anda, PH1 teşhisi konan çocuk ve bebeklerin bakımı Standartlar, aşırı hidrasyon için sıklıkla bir gastrostomi tüpü yerleştirme ihtiyacı da dahil olmak üzere çok zahmetlidir ve ilerlemiş hastalık geliştiren hastalar için, diyaliz ve nihayetinde organ riski vardır. transplantasyon. Bu nedenle, idrar oksalik asit seviyesinin önemli olduğuna inanıyoruz. Azaltmanın, çok genç hastalarda hastalığın ilerlemesi ve tedavisi üzerinde olumlu bir etkisi olma potansiyeline sahiptir."
Oxalosis ve Hyperoxaluria Vakfı'nın yönetici direktörü Kim Hollander şunları söyledi: “ILUMINATE-B'nin sonuçları PH1'den etkilenen birçok çocuğun aileleri için umut gösteriyor. Bu özellikle cesaret vericidir, çünkü sadece birkaç aylık çocuklar kaynaktan oksalik asit üretimini kontrol etmek için lumasiran tarafından sağlanan tedaviden yararlanabilirler. Alnylam'a PH1 topluluğuna sürekli bağlılığı ve özellikle savunmasız hasta Grupları için yeni yürümeye başlayan çocuklar ve bebeklerle ilgili bir proje tasarladığı ve başarıyla başlattığı için teşekkür ederiz."
PH1, böbrekleri ve diğer hayati organları etkileyen süper nadir, ilerleyici, yıkıcı bir hastalıktır. Hastalığa aşırı oksalik asit üretimi neden olur. Yüksek idrar oksalik asit seviyeleri, son dönem böbrek hastalığına ilerleme ve diğer sistemik komplikasyonlar ile ilişkilidir. PH1 böbrek yetmezliğine neden olabilir, önemli morbidite ve mortaliteye sahiptir ve onaylanmış bir ilaç yoktur. Mevcut tedavi yöntemleri aşırı oksalat üretimini engelleyemez, ancak sadece böbreklere verilen hasarı azaltır ve ESKD'nin ilerlemesini geciktirir. PH1 bebekleri, çocukları ve yetişkinleri etkiler. Hastalar, tekrarlayan ve ağrılı diş taşı olaylarının yanı sıra böbrek fonksiyonunda ilerleyen ve tahmin edilemeyen düşüşlerle karşı karşıya kalırlar, bu da sonuçta son dönem böbrek hastalığına yol açar ve ikili karaciğer / böbrek nakli için bir köprü olarak yoğun diyaliz gerektirir. . PH1 genellikle çocukluk döneminde gelişir ve acil ve etkili müdahale gerektirir. İleri hastaların diyalizden başka seçeneği yoktur. Karaciğer nakli şu anda hastalığın temel nedenini çözen tek tedavi yöntemidir.
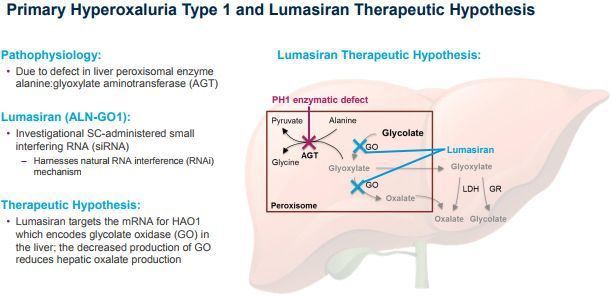
Lumasiran, primer hiperoksalüri tip 1 (PH1) tedavisi için geliştirilmiş, hidroksi asit oksidaz 1'i (HAO1) hedefleyen subkutan bir RNAi ilacıdır. HAO1, glikolat oksidazı (GO) kodlar. Bu nedenle, HAO1'i susturarak ve GO enzimlerini tüketerek lumasiran, karaciğerde oksalik asit (doğrudan PH1 patofizyolojisine dahil olan metabolit) üretimini inhibe edebilir ve normalleştirebilir, böylece potansiyel olarak PH1 hastalığının ilerlemesini önleyebilir.
Lumasiran, idrar oksalat atılımında önemli bir azalma gösteren ilk tedavidir. Faz III ILLUMINATE-A çalışmasının (NCT03681184) sonuçları, lumasiran'ın karaciğerde oksalik asit üretimini önemli ölçüde azalttığını, PH1'in doğal patofizyolojik sorunlarını çözme potansiyeline sahip olduğunu ve üzerinde anlamlı bir klinik etkiye sahip olma potansiyeline sahip olduğunu doğruladı. PH1 hastaları. Amerika Birleşik Devletleri'nde, lumasiran'a PH1 tedavisi için FDA tarafından pediatrik nadir hastalık durumu, yetim ilaç durumu (ODD) ve çığır açan ilaç durumu (BTD) verilmiştir. Avrupa Birliği'nde lumasiran'a Yetim İlaç Tanımlaması (ODD) ve Öncelikli İlaç Tanımlaması (PRIME) verilmiştir. Bu nitelikler birlikte lumasiran'ın PH1'in potansiyel patofizyolojik sorunlarını çözme potansiyelini vurgulamaktadır.
Lumasiran, Alnylam&# 39'un en son geliştirilmiş ve stabil kimyasal ESC-GalNAc konjugat teknolojisi geliştirmesini benimser; bu, subkutan uygulamanın daha güçlü etkinlik ve dayanıklılığa sahip olmasını sağlar ve geniş bir terapötik indekse sahiptir. Şu anda Alnylam, ilerlemiş böbrek hastalığı olan her yaştaki PH1 hastalarının tedavisinde lumasiran'ı değerlendirmek için başka bir global faz III çalışması olan ILLUMINATE-C'yi yürütmektedir ve sonuçların 2021'de alınması beklenmektedir.