Temas etmek:Erol Çu (Bay.)
Tel: artı 86-551-65523315
Mobil/WhatsApp: artı 86 17705606359
Soru:196299583
Skype:lucytoday@hotmail.com
E-posta:sales@homesunshinepharma.com
Eklemek:1002, Huanmao Bina, No.105, Mengcheng Yol, Hefei Şehir, 230061, Çin
Merkezi Avustralya'nın Sidney şehrinde bulunan Kazia Therapeutics, yenilikçi anti-kanser ilaçlarının geliştirilmesine adanmış onkolojiye odaklanmış bir biyoteknoloji şirketidir. Son zamanlarda şirket, ABD Gıda ve İlaç Dairesi'nin (FDA), yaygın endojen pontin glioma (DIPG) tedavisi için paxalisib'e (eski adıyla GDC-0084) nadir pediatrik hastalık durumu (RPDD) verdiğini duyurdu. . Bu, son derece etkili tedavi eksikliği olan ve ölüm oranı çok yüksek olan, nadir görülen ve oldukça agresif bir çocukluk çağı tümörüdür.
Paxalisib, kan-beyin bariyerini geçebilen PI3K / AKT / mTOR yolağının küçük bir molekül inhibitörü olan Kazia&# 39'un öncü ilaç adayıdır. 2016 sonunda Roche' Genentech tarafından yetkilendirildi ve 2018'de Faz II klinik araştırmalarına girdi. en yaygın ve agresif birincil beyin kanseri.
Paxalisib-GDC-0084'ün kimyasal yapısı (resim kaynağı: selleckchem.com)
GG quot; Gıda ve İlaç İdaresi Güvenlik ve Yenilik Yasası" (2012) FDA&# 39'un RPDD planını oluşturdu. RPDD, Amerika Birleşik Devletleri'nde esas olarak çocukları (18 yaşın altında) etkileyen, her yıl 200.000'den az vaka, ciddi veya yaşamı tehdit eden hastalıkların yeni insidans oranıyla araştırılan ilaçlara verilebilir. RPDD programı, endüstriye teşvikler yoluyla bazı ciddi ve yaşamı tehdit eden nadir pediatrik hastalıklar için ilaç ve biyolojik ajanların geliştirilmesini teşvik etmeyi amaçlamaktadır. Bu teşvik önleminde en önemli şey, FDA'nın geliştirilmekte olan ilaç bu nadir pediatrik hastalık için yeni bir ilaç için onaylandığında geliştiriciye bir Öncelikli İnceleme Kuponu (PRV) vermesidir.
RPDD'nin bir sonucu olarak, paxalisib DIPG tedavisi için onaylanırsa, Kazia bir" nadir pediatrik hastalık öncelikli inceleme kuponu (PRV) için uygun olacaktır." PRV sahipleri, FDA'ya sunulan yeni ilaç başvurusunun 6 aylık hızlandırılmış bir incelemesini talep edebilir (normal inceleme süresi 12 aydır). PRV, 68 milyon ABD Doları ile 350 milyon ABD Doları arasında tarihsel bir fiyatla diğer şirketlere satılabilir. Yüksek ticari potansiyele sahip yeni bir ilacı piyasaya sürmeyi planlayan büyük ilaç şirketleri için, düzenleyici incelemenin altı aylık hızlanması önemli ekonomik değere sahip olabilir. 2019 yılında FDA toplam 5 pediatrik PRV yayınladı.
Paxalisib, DIPG tedavisi için preklinik pozitif veriler elde etmiştir ve 2020 mali yılının ikinci yarısında ön klinik etkililik verilerinin elde edilmesi beklenmektedir. Pozitif bir sonuç elde edilirse, gelecekte FDA.
Kazia CEO'su Dr. James Garner şunları söyledi:" Glioblastoma hala paxalisibin ana odak noktası olmasına rağmen, çocukluk çağı beyin kanserini tedavi etmek için paxalisib'in geliştirilmesi üzerinde çalışıyoruz. DIPG teşhisi konan hastalar için, şu anda FDA Onaylı ilaç tedavilerinin teşhisten sonra yaklaşık 9,5 aylık ortalama hayatta kalma süresi yoktur. FDA, şimdiye kadarki çabalarımızı ve başarılarımızı onaylayarak RPDD'yi verir ve paxalisib'i DIPG için potansiyel bir tedavi olarak daha iyi tanıtmamıza izin verir. Ve paxalisib'in bu son derece zorlu pediatrik hastalığın tedavisine yardımcı olup olamayacağını anlamaya kararlıdır."
Bu yılın Nisan ayı başlarında Kazia, glioblastoma multiforme (GBM) tedavisinde paxalisib'i değerlendiren devam eden Faz II çalışmasının (NCT03522298) pozitif ara verilerini açıkladı. Çalışma, metile edilmemiş MGMT promoter statüsüne sahip yeni teşhis edilmiş GBM hastalarında gerçekleştirilmekte ve paxalisib'in, eşzamanlı radyoterapi ve kemoterapi ile birlikte maksimum cerrahi rezeksiyon ve temozolomid (TMZ) uygulanan hastalarda adjuvan tedavi olarak güvenliğini değerlendirmektedir Direnç, tolerabilite, önerilen faz II dozu (RP2D), farmakokinetik (PK) ve klinik aktivite. TMZ şu anda GBM için standart bakım tedavisidir.
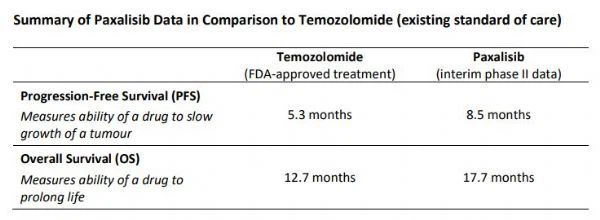
Sonuçlar şunları gösterdi: (1) Adjuvan paxalisib tedavisinin medyan genel sağkalımı (OS) 17.7 aydı ve bu, mevcut standart bakım TMZ ile ilişkili 12.7 ay ile karşılaştırıldığında klinik olarak anlamlı bir yaşam uzatmasını temsil ediyor. (2) Adjuvan paxalisib tedavisinin ilerlemesiz medyan sağkalımı (PFS) 8,5 aydır ve bu, 5,3 aylık mevcut standart bakım TMZ ile karşılaştırıldığında olumlu bir sonucu temsil eder. (3) En uzun tedavi süresi alan hastalar tanıdan 19 ay sonra hastalıksız kaldı. (4) Kaydolan hastaların yaklaşık yarısı hala paxalisib tedavisi almaktadır. Çalışma devam ettikçe, OS ve PFS verileri daha da gelişebilir.
Çalışmanın diğer verilerinin 2020 mali yılının ikinci yarısında açıklanması ve nihai verilerin 2021 mali yılının ilk yarısında açıklanması bekleniyor. Yeni herhangi bir antikanser ilaç için," altın standart" yaşam süresini uzatma yeteneğidir - bu, özellikle glioblastoma (GBM) gibi hastalıklarda zorlu bir hedeftir. Bu yeni veriler, paxalisib'in çok zorlu hasta popülasyonunda bu hedefe ulaşma potansiyeline sahip olduğuna dair ilk klinik kanıtı sağlar.
Yirmi yıldan fazla bir süredir, yeni teşhis edilmiş glioblastoma hastaları yeni ilaç almadı. Paxalisib, bu son derece zorlu hastalık için küresel boru hattında hızla en umut verici ilaç adaylarından biri haline geliyor.